Phản ứng Fe2O3 Al thuộc loại phản ứng nhiệt nhôm tạo ra Al2O3 và Fe. Vậy phương trình hóa học này được cân bằng như thế nào và số mol và khối lượng của các chất tham gia phản ứng là gì? Mời các bạn đón xem phương trình được cân bằng chính xác và chi tiết nhất và củng cố kiến thức kiến thức với một số bài tập vận dụng ngay sau đây.

Cân bằng phương trình hóa học: Fe2O3 Al → ?
Phương trình hóa học Fe2O3 + Al → ? chưa được cân bằng.
Để cân bằng phương trình hóa học này, ta cần xác định số hợp chất của mỗi nguyên tố trong phản ứng. Số oxi hóa của Fe trong Fe2O3 là +3, còn số oxi hóa của Al là 0. Trong sản phẩm Al2O3, số oxi hóa của Al là +3, còn số oxi hóa của O là -2.
Vì vậy, phương trình đã cân bằng sẽ có dạng:
| Fe2O3 + 2Al → Al2O3 + 2Fe |
Điều kiện phản ứng của các chất tham gia
- Phản ứng này được kích thích bởi nhiệt độ cao, thường được thực hiện trong lò nung
Cách thực hiện phản ứng
- Nung Al (Nhôm) và Fe2O3(oxi sắt) ở điều kiện nhiệt độ cao.
Hiện tượng nhận biết phản ứng
- Nhôm oxi Al2O3 sẽ kết tủa trắng, màu đỏ của Fe2O3 mất dần thành màu trắng xám của Fe.
Số mol và khối lượng các chất trong phản ứng của Fe2O3 Al
Trong phản ứng này, số mol của các chất tham gia và sản phẩm đã được cân bằng và tỉ lệ mol giữa các chất tham gia và sản phẩm là 1:2:1:2.
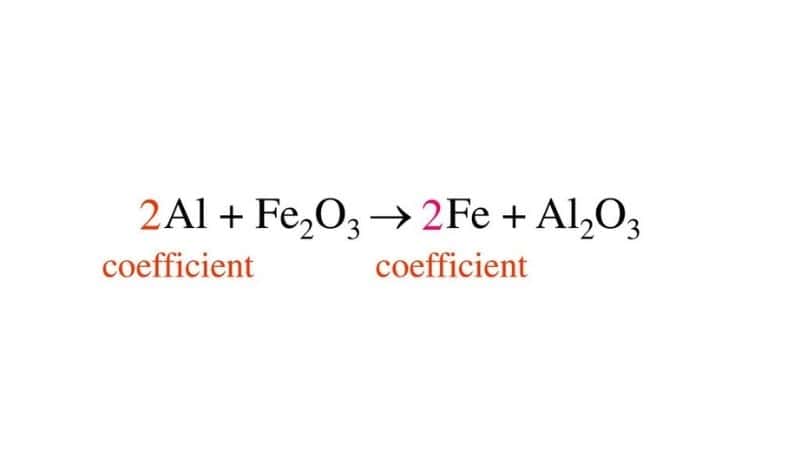
Các chất tham gia và sản phẩm của phản ứng 2Al + Fe2O3 → Al2O3 + 2Fe
Phương trình hóa học 2Al + Fe2O3 → Al2O3 + 2Fe cho biết rằng trong phản ứng này, 2 mol nhôm (Al) tác dụng với 1 mol oxit sắt (Fe2O3) để tạo ra 1 mol nhôm oxit (Al2O3) và 2 mol sắt (Fe).
Phương trình hóa học thể hiện quá trình chuyển đổi các chất tham gia thành sản phẩm và là công cụ quan trọng trong việc tính toán các thông số trong phản ứng hóa học.
Số mol và khối lượng các chất trong phản ứng 2Al + Fe2O3 → Al2O3 + 2Fe
Trong phản ứng hóa học 2Al + Fe2O3 → Al2O3 + 2Fe, số mol của các chất tham gia và sản phẩm lần lượt là:
- 2 mol Al
- 1 mol Fe2O3
- 1 mol Al2O3
- 2 mol Fe
Để tính khối lượng của các chất trong phản ứng, cần biết khối lượng mol của mỗi chất. Khối lượng mol của Al là 26.98 g/mol, Fe2O3 là 159.69 g/mol, Al2O3 là 101.96 g/mol và Fe là 55.85 g/mol.
Vậy khối lượng của các chất tham gia và sản phẩm lần lượt là:
- 2 mol Al có khối lượng là: 2 x 26.98 = 53.96 g
- 1 mol Fe2O3 có khối lượng là: 1 x 159.69 = 159.69 g
- 1 mol Al2O3 có khối lượng là: 1 x 101.96 = 101.96 g
- 2 mol Fe có khối lượng là: 2 x 55.85 = 111.70 g
Tỉ lệ mol giữa các chất trong phương trình hóa học 2Al + Fe2O3 → Al2O3 + 2Fe
Trong phản ứng hóa học 2Al + Fe2O3 → Al2O3 + 2Fe, tỉ lệ mol giữa các chất tham gia và sản phẩm là 2:1:1:2. Tức là, cần 2 mol nhôm (Al) và 1 mol oxit sắt (Fe2O3) để tạo ra 1 mol nhôm oxit (Al2O3) và 2 mol sắt (Fe).
Phân loại của phương trình Fe2O3 Al → ?
Phương trình hóa học 2Al + Fe2O3 → Al2O3 + 2Fe là phản ứng oxi-hoá khử. Trong đó, nhôm (Al) bị oxi hóa từ trạng thái +0 lên trạng thái +3 để tạo thành oxit nhôm (Al2O3), trong khi đó sắt (Fe) bị khử từ trạng thái +3 xuống trạng thái 0 để tạo thành kim loại sắt (Fe).

Phản ứng oxi-hoá khử.
Trong phản ứng hóa học 2Al + Fe2O3 → Al2O3 + 2Fe, Fe2O3 bị khử thành sắt (Fe), còn nhôm (Al) bị oxi hóa thành nhôm oxit (Al2O3).
Cụ thể, trong Fe2O3, nguyên tử sắt có số oxi hóa là +3, còn trong sản phẩm Fe, số oxi hóa của sắt là 0. Đây là quá trình khử.
Trong khi đó, trong Al, nguyên tử nhôm có số oxi hóa là 0, còn trong sản phẩm Al2O3, số oxi hóa của nhôm là +3. Đây là quá trình oxi hóa.
Vì vậy, phản ứng 2Al + Fe2O3 → Al2O3 + 2Fe là một phản ứng oxi-hoá khử.
PTHH: 2Al + Fe2O3 → 2Fe + Al2O3
Phản ứng nhiệt nhôm
Phản ứng nhiệt nhôm của Fe2O3 Al là được kích thích bởi nhiệt độ cao, thường được thực hiện trong lò nung.
Phương trình tổng quát:
Al + oxit kim loại → oxit nhôm + kim loại
(Hỗn hợp X) → (Hỗn hợp Y)
Chuỗi phương trình hóa học có sử dụng Fe2O3 Al
Đầu tiên, tiến hành đốt cháy Fe(OH)3 sẽ thu được Fe2O3.
Sau đó, cho Al tác dụng với Fe2O3 sẽ thu được Fe và muối nhôm.
Cuối cùng, cho Fe tác dụng với CuSO4 sẽ thu được FeSO4.
Bài tập vận dụng Fe2O3 Al
Dưới đây là một số bài tập vận dụng liên quan đến Fe2O3 Al trong chương trình giáo dục:
Câu 1. Phản ứng hóa học xảy ra trong trường hợp nào dưới đây không thuộc loại phản ứng nhiệt nhôm?
A. Al tác dụng với H2SO4 đặc, nóng.
B. Al tác dụng với CuO nung nóng.
C. Al tác dụng với Fe2O3 nung nóng.
D. Al tác dụng với Fe3O4nung nóng.
Câu 2. Để giữ cho các đồ dùng, đồ vật làm từ kim loại nhôm được bền, đẹp thì cần phải:
(1) Ngâm đồ vật trong nước xà phòng đặc, nóng, để làm sạch.
(2) Không nên cho đồ vật tiếp xúc với dung dịch nước chanh, giấm ăn.
(3) Dùng giấy nhám, chà trên bề mặt của vật, để vật được sạch và sáng.
(4) Bảo vệ bề mặt của vật như nhà thiết kế, sản xuất ban đầu.
Cách nào làm trên là đúng:
A. 1 và 2
B. 1 và 3
C. 1 và 4
D. 2 và 4
Câu 3. Hỗn hợp X gồm Fe2O3 và Al có tỉ lệ mol tương ứng là 1:3. Thực hiện phản ứng nhiệt nhôm X (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm
A. Al2O3 và Fe
B. Al, Fe và Al2O3
C. Al, Fe, Fe3O4 và Al2O3
D. Al2O3, Fe và Fe3O4
Câu 4. Trộn 8,1 (g) bột Al với 48g bột Fe2O3 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí, kết thúc thí nghiệm lượng chất rắn thu được là:
A. 61,5 g
B. 56,1 g
C. 65,1g
D. 51,6 g
Câu 5. Phương trình nào sau đây là phản ứng nhiệt nhôm?
A. H2 + CuO → Cu + H2O.
B. 3CO + Fe2O3→ 2Fe + 3CO2.
C. 2Al + Cr2O3 → Al2O3 + 2Cr.
D. Al2O3 + 2KOH → 2KAlO2 + H2O.
Câu 6. Cho sơ đồ phản ứng : Al → X → Al2O3→ Al
X có thể là
A. AlCl3.
B. NaAlO2.
C. Al(NO3)3.
D. Al2(SO4)3.
Câu 7. Trong các cặp chất sau đây, cặp chất nào có thể cùng tồn tại trong một dung dịch?
A. AlCl3 và Na2CO3
B. HNO3 và NaHCO3
C. NaNO3 và KOH
D. NaCl và AgNO3
Câu 8. Đốt nóng một hỗn hợp gồm Al và 8 gam Fe2O3 (trong điều kiện không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn R. Cho X tác dụng vừa đủ với V ml dung dịch NaOH 1M sinh ra 1,68 lít H2 (ở đktc). Giá trị của V là
A. 150.
B. 100.
C. 200.
D. 300.
Câu 9. Phản ứng hóa học xảy ra trong trường hợp nào dưới đây không thuộc loại phản ứng nhiệt nhôm?
A. Al tác dụng với H2SO4 đặc, nóng.
B. Al tác dụng với CuO nung nóng.
C. Al tác dụng với Fe2O3 nung nóng.
D. Al tác dụng với Fe3O4 nung nóng.
Câu 10. Phản ứng nào sau đây là phản ứng nhiệt nhôm?
A. 4Al + 3O2 → 2Al2O3
B. 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
C. Al + 4HNO3 →Al(NO3)3 + NO + 2H2O
D. 2Al + Fe2O3 → 2Fe + Al2O3
Câu 11. Tính chất nào sau đây không phải của nhôm?
A. Là kim loại màu trắng bạc, mềm, dễ kéo sợi và dát mỏng.
B. Nhôm dẫn điện và dẫn nhiệt tốt, tốt hơn các kim loại Fe và Cu.
C. Nhôm là nguyên tố p.
D. Nhôm là kim loại nhẹ.
Câu 12. Nhôm thể hiện tính chất nào sau đây?
1) Là kim loại màu trắng bạc, mềm, dễ kéo sợi và dát mỏng.
2) Nhôm dẫn điện và dẫn nhiệt tốt, tốt hơn các kim loại Fe và Cu.
3) Nhôm là kim loại nhẹ.
4) Nhôm là nguyên tố s.
A. 1, 2
B. 2, 4
C. 3
D. 1, 3
Câu 13. Cho các ống nghiệm đựng các dung dịch sau: HCl, H2SO4 đặc nguội, ZnCl2, KCl. Thả bột nhôm vào các ống nghiệm thấy có hiện tượng lần lượt là
A. sủi bọt khí, không hiện tượng, xuất hiện kết tủa màu đỏ, không hiện tượng.
B. không hiện tượng, sủi bọt khí, không hiện tượng, xuất hiện kết tủa vàng.
C. xuất hiện khói trắng, sủi bọt khí, xuất hiện kết tủa nâu đỏ, không hiện tượng.
D. sủi bọt khí, xuất hiện khói trắng, xuất hiện kết tủa màu đỏ, không hiện tượng.
Câu 14. Nhúng thanh nhôm vào dung dịch Cu(NO3)2sau một thời gian thấy hiện tượng gì xảy ra:
A. màu xanh lam nhạt dần và có kết tủa màu đỏ lắng xuống đáy ống nghiệm.
B. màu xanh lam chuyển dần nâu đỏ và có chất rắn màu đỏ bám vào thanh nhôm.
C. màu xanh lam đậm dần và có chất rắn màu trắng bám vào thanh nhôm.
D. màu xanh lam nhạt dần và có chất rắn màu đỏ bám vào thanh nhôm.
Câu 15. Có các nhận xét sau về clo và hợp chất của clo
- Nước Gia-ven có khả năng tẩy màu và sát khuẩn.
- Cho giấy quì tím vào dung dịch nước clo thì quì tím chuyển màu đỏ sau đó lại mất màu.
- Trong phản ứng của HCl với MnO2 thì HCl đóng vai trò là chất bị khử.
- Trong công nghiệp, Cl2 được điều chế bằng cách điện phân dung dịch NaCl (màng ngăn, điện cực trơ).
Trong các nhận xét trên, số nhận xét đúng là
A. 2
B. 3
C. 4
D. 1
Lời kết
Bài viết trên đây là toàn bộ thông tin chi tiết cũng như cách công bằng chính xác nhất về phản ứng oxi hóa khử của các chất tham gia là Fe2O3 Al được Giadinhvatreem tổng hợp cho bạn đọc tham khảo. Hy vọng với những bài tập vận dụng có thể hỗ trợ các bạn củng cố kiến thức và đạt kết quả tốt trong học tập.
